Monossido di carbonio: natura chimica, metodi di produzione, effetti sulla salute e sistemi di trattamento
Scopri con noi le caratteristiche di questa specie chimica, le problematiche derivanti da una sua produzione involontaria e le tecnologie in uso per abbatterlo
Cos’è il monossido di carbonio? Come viene prodotto? Quali sono i suoi utilizzi nel mondo industriale? Perché, in alcuni contesti, è una specie inquinante indesiderata, nei confronti della quale intervenire?
In questo articolo esamineremo insieme le interessanti risposte a queste domande, per comprendere al meglio il ruolo di questa specie chimica e le problematiche che possono emergere quando si ha una sua produzione non voluta.
Partiamo dall’analisi del primo quesito.
Cos’è il monossido di carbonio?
Il monossido di carbonio è una molecola in cui un atomo di carbonio (C) e un atomo di ossigeno (O) sono legati covalentemente tra di loro. Le proprietà di una molecola dipendono notevolmente dalla natura dei legami tra gli atomi che la compongono: per questo è importante esaminarli.
Immagina di unire due oggetti con una fune. Ora immagina di unirli con due funi in parallelo, e poi immagina di unirli con tre funi! A livello intuitivo, puoi notare come la connessione tra i due oggetti sia tanto più forte tante più sono le funi che li legano.
Per le molecole il ragionamento è analogo: se due atomi sono legati da un legame singolo, doppio o triplo, la loro connessione diventa via via più forte.
Ti faccio subito un esempio. Consideriamo l’aria che respiriamo ogni giorno. L’aria risulta essere principalmente composta da azoto molecolare (N2, che compone circa il 79% dell’aria) e da ossigeno molecolare (O2, che compone circa il 21% dell’aria). Nell’azoto molecolare, i due atomi di azoto sono legati da un triplo legame. Nell’ossigeno molecolare, tra i due atomi di ossigeno intercorre un legame doppio.
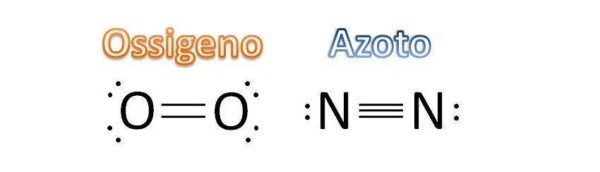
La presenza del doppio e del triplo legame rende la reattività dei due composti completamente diversa. L’ossigeno molecolare reagisce in molti contesti: pensa che, grazie al processo di respirazione cellulare, è alla base del nostro metabolismo energetico. L’azoto invece, in conseguenza alla presenza del triplo legame, risulta essere molto più restio a reagire e a modificare la sua struttura molecolare. Reagisce tipicamente in condizioni molto spinte: ad esempio, ad alte temperature reagisce con l’ossigeno per formare i temuti NOx.
Cosa c’entra tutto questo con il monossido di carbonio? Utilizziamo l’analisi svolta come base, per comprendere la tipologia di legame presente in questa molecola.
Il legame caratteristico della molecola di CO – Ossido di carbonio
Tra il carbonio e l’ossigeno è presente un legame doppio o un legame triplo? La risposta può essere doppia: nessuno dei due, o entrambi. In che senso? L’immagine chiarisce il concetto.
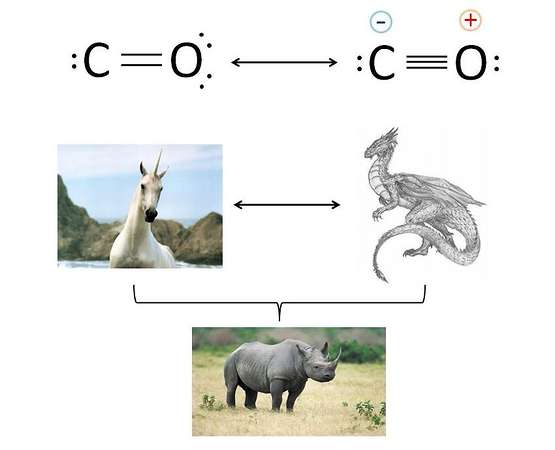
Il monossido di carbonio ha due strutture limite di risonanza. In altri termini, il legame presente in questa molecola può essere descritto a partire da due configurazioni diverse:
- Nella prima configurazione, tra C e O intercorre un legame doppio, e i due atomi hanno carica formale nulla.
- Nella seconda configurazione, l’ossigeno condivide un ulteriore doppietto elettronico e tra i due atomi c’è un legame triplo, con la presenza di cariche formali. In particolar modo, il carbonio ha carica formale negativa e l’ossigeno carica formale positiva. La reale struttura del CO è un mix tra le due strutture limite di risonanza, in cui la struttura a stabilità maggiore (sperimentalmente, quella con le cariche formali) fornisce il maggior contributo.
Per comprendere meglio il concetto, guarda la parte inferiore dell’immagine: né l’unicorno né il drago (metafora delle due strutture limite di risonanza) esistono, eiste invece un loro possibile mix che, immaginiamo, sia il rinoceronte, (ovvero una struttura reale, visto che si tratta di un animale esistente).
Il legame caratteristico del CO, in sostanza, non è né doppio né triplo, ma assomiglia molto più a quello triplo. Gli atomi di carbonio e di ossigeno non hanno cariche nette, ma hanno comunque delle cariche di entità significativa.
Sono proprio queste cariche che influiscono sulla reattività del monossido di carbonio. Mentre l’azoto molecolare ha un legame triplo e carica neutra (elementi che, in compresenza, lo rendono poco reattivo), il monossido di carbonio ha un legame molto simile ad un legame triplo ma ha anche una separazione di carica. Questo incrementa notevolmente la reattività della molecola.
Ora che abbiamo compreso la struttura di questa molecola, esaminiamo il suo utilizzo nel mondo industriale.
Quali sono gli utilizzi del monossido di carbonio, come viene prodotto?
Ci tengo a chiarire subito un concetto: il monossido di carbonio è una molecola essenziale per la realtà moderna. Quest’ultimo, insieme all’idrogeno molecolare (H2), forma una miscela assai cara all’industria chimica, denominata syngas. Il syngas, o gas di sintesi, risulta essere il punto di partenza per innumerevoli sintesi dei mondi della chimica industriale organica e inorganica.
Si pensi, ad esempio, che a partire da monossido di carbonio e idrogeno molecolare si sintetizza il metanolo. Il metanolo, a sua volta, è coinvolto nella sintesi di molti composti di elevata importanza (acido acetico, formaldeide,…), e questi composti a loro volta generano molti materiali che caratterizzano la nostra vita quotidiana. Insomma, la sua importanza è elevata.
Come si produce il syngas? Nella pratica industriale, sono possibili diverse vie:
Steam Reforming (SR)
Questa reazione prevede l’interazione tra molecole idrocarburiche e acqua, per formare CO e H2. Considerando la specie idrocarburica più semplice (il metano), la reazione risulta essere la seguente:
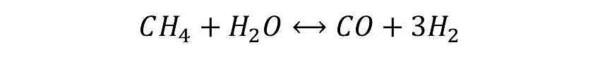
La reazione riportata risulta essere estremamente endotermica (richiede molto calore). Per questo motivo viene condotta in appositi reattori, in cui sono presenti dei bruciatori che scaldano i tubi per irraggiamento e convezione.
Ossidazione Parziale (OP)
Le specie idrocarburiche, se sottoposte ad un processo di ossidazione totale, tendono a generare acqua (H2O) e anidride carbonica (CO2). La quantità di ossigeno necessaria a far avvenire questo processo viene denominata quantità stechiometrica. Se al processo di combustione viene alimentata una quantità di ossigeno inferiore a quella stechiometrica, le specie idrocarburiche non potranno andare incontro ad un’ossidazione totale, e subiranno quindi un processo di ossidazione parziale, che genera CO e H2. Considerando nuovamente il metano, la stechiometria del processo è la seguente.
Questa reazione, al contrario di quella precedentemente descritta, risulta avere un carattere spiccatamente esotermico (sprigiona molto calore)
Reforming Autotermico (RA)
Lo Steam Reforming e l’Ossidazione Parziale, come visto in precedenza, hanno rispettivamente carattere endotermico ed esotermico. Risulta spontanea una domanda: perché non sfruttare il calore generato dalla seconda reazione per far avvenire la prima? Sulla base di questa domanda si è sviluppato il Reforming Autotermico, che si avvale delle reazioni precedentemente descritte per ottenere il syngas.
E se la produzione di CO è … indesiderata?
Ebbene, sino ad ora abbiamo esaminato un contesto in cui la produzione di monossido di carbonio era desiderata. Vi sono molti contesti, che coinvolgono principalmente processi di combustione, in cui la produzione di CO è indesiderata, e in cui questa specie può essere vista come una vera e propria specie inquinante. Come avviene la sua produzione, in questi contesti?
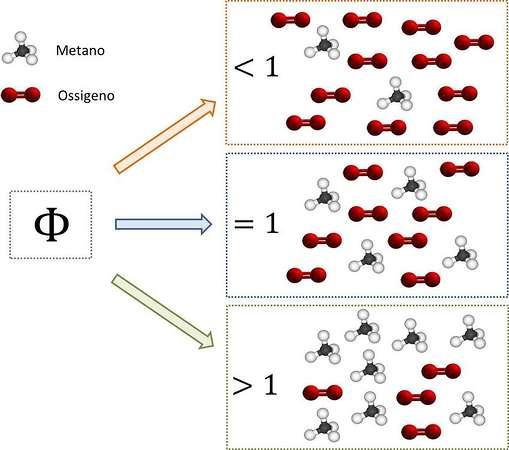
In un precedente articolo, dedicato ai TAR, abbiamo introdotto il concetto di rapporto equivalente (che confronta le quantità relative di combustibile e di aria nelle condizioni di esercizio e nelle condizioni stechiometriche). Avevamo anche visto che, pur alimentando un adeguato contenuto di aria (utile alla combustione completa), in conseguenza dell’inefficienza dei fenomeni di miscelazione, possono crearsi delle zone con eccesso di combustibile e delle zone con carenza di combustibile. Nelle zone con eccesso di combustibile risulta impossibile il raggiungimento della condizione di combustione completa, e si formeranno dunque dei prodotti di combustione parziale (tra i quali, appunto, il CO).
Siamo pronti per esaminare gli effetti dannosi del CO per gli esseri umani e come intervenire, per ridurne la formazione o per abbatterlo.
CO – carbon oxide – che effetti ha? Come intervenire?
Effetti sulla salute umana del monossido di carbonio
Il monossido di carbonio risulta essere un composto estremamente tossico, la cui inalazione può condurre alla perdita dei sensi e alla morte. Cosa rende questo composto così pericoloso per l’essere umano? Per spiegarlo, consideriamo il fenomeno della respirazione:
L’ossigeno che entra nei nostri polmoni viene poi trasportato in giro per il corpo grazie ai globuli rossi.
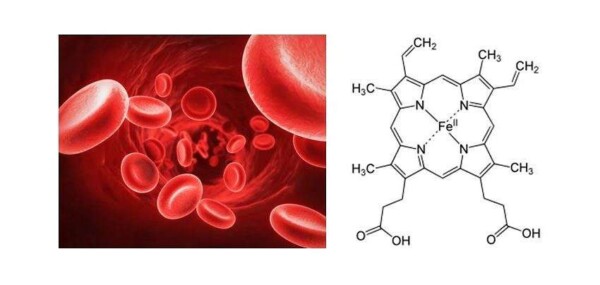
All’interno dei globuli rossi è presente una cromoproteina denominata emoglobina, la quale a sua volta contiene i gruppi eme (rappresentati in figura a destra). La funzione di questi gruppi risulta essere di estrema importanza nel processo di respirazione. Il loro ruolo è infatti quello di coordinare ai globuli rossi le molecole di ossigeno introdotte mediante la respirazione, e provvedere dunque al loro trasporto all’interno del sistema sanguigno. Senza questo processo le nostre cellule non avrebbero a disposizione l’ossigeno necessario al loro metabolismo.
Cosa succede quando respiriamo del monossido di carbonio? Anche questa molecola è in grado di legarsi al gruppo eme dei globuli rossi, ma in modo molto più intenso rispetto alle molecole di ossigeno molecolare. Infatti, mentre il legame tra globuli rossi e ossigeno molecolare ha natura reversibile (e permette dunque il rilascio dell’ossigeno stesso nelle zone di necessità), il legame tra globuli rossi e monossido di carbonio conduce alla formazione di carbossiemoglobina, un complesso molto stabile. Respirando monossido di carbonio, quindi, si va incontro ad una rapida saturazione dei globuli rossi disponibili, e ad una conseguente perdita della capacità di trasporto dell’ossigeno. Come detto precedentemente, per concentrazioni significative di CO, questo processo può condurre alla perdita dei sensi e alla morte per anossia.
Quali tecnologie industriali esistono per abbattere e trattare il CO?
Com’è possibile influire sui processi di formazione del monossido di carbonio, o rimuoverlo da correnti gassose quando è già avvenuta la sua sintesi?
Intervento a monte del processo (preventivo)
Ragioniamo innanzitutto in via preventiva. Abbiamo visto in precedenza che, nei processi di combustione, il monossido di carbonio viene sintetizzato in conseguenza alle inefficienze di miscelazione. Una carente miscelazione a livello molecolare può condurre alla genesi di zone ricche di combustibile: in queste zone non vi è sufficiente ossigeno per promuovere un’ossidazione completa delle molecole idrocarburiche, con conseguente formazione di prodotti di combustione parziale.
Come intervenire? Sulla base di quanto detto, la risposta è semplice: favorire la miscelazione. Questo può essere fatto in fase di progettazione e costruzione della caldaia, oppure prevedendo delle opportune metodologie di ricircolo dei fumi (che permettono tra l’altro di ridurre le emissioni di NOx).
Intervento a valle del processo di formazione del CO
Il processo di rimozione avviene in modo può essere effettuato:
- mediante un post-combustore termico, contenente un opportuno sistema catalitico, che converte le molecole parzialmente ossidate nel loro corrispettivo ossidato.
- nel settore automotive si tende invece ad utilizzare delle opportune marmitte catalitiche, che mediante appositi metalli di transizione operano e promuovono la conversione di CO in CO2.
La tecnologia di post-combustione progettata da Tecnosida® prende il nome di THEROX, per maggiori dettagli, ti invito a consultare le seguenti pagine:
Di seguito puoi trovare anche alcune nostre Case History relative all’installazione del post combustore THEROX:
- Installazioni e use cases post combustore termico – Tre realizzazioni in settori industriali differenti
Iscriviti alla nostra newsletter per restare sempre aggiornato sulle novità Tecnosida®!
A presto !